Experiment 3: El soroll de la química
EXPERIMENT 3: El soroll de la química
El fundador de la química moderna, Antoine Lavoisier (1743-1794) estava obsessionat amb una única cosa: mesurar... però quantificar en química no és fàcil. Fixeu-vos que Isaac Newton (1643-1727) va desenvolupar la física que estudieu cent anys abans que Lavoisier la química!! Nosaltres però, ens hem proposat un repte: amb allò que podem trobar a casa, farem una mesura molt acurada de la rapidesa d'una reacció química!, i a més estudiarem com varia amb la temperatura.... i tot això "escoltant" el soroll que fa!
L'Emilio Jiménez, professor de l'Escola d'Enginyeria de Barcelona Est, i investigador del CIEFMA ens explica a STEAM-ANELLA què són els enllaços químics, i com crear una molècula de CO2, per preparar-nos pel nostre experiment.
1.- Ens preparem
Una molècula està composta d'àtoms units d'una forma més o menys forta entre si. En barrejar dues molècules diferents pot no passar res: ambdues molècules estan contentes amb els àtoms que tenen... però també pot passar que un àtom d'una molècula prefereixi estar amb la molècula competidora. En aquest cas els àtoms que formen cadascuna de les molècules canvien. Direm llavors, que s'ha produït una "reacció química". A més, aquest bescanvi d'àtoms es fa molt més ràpidament si la temperatura és alta. Això és degut pel fet que àtoms i molècules es mouen més ràpid a temperatures altes, cosa que incrementa la probabilitat i energia dels seus xocs i per tant la possibilitat de bescanvi d'àtoms.
En l'experiment que us proposem barrejarem un àcid amb una sal*. Si l'àcid és l'àcid acètic i la sal és el bicarbonat de sodi, l'àtom pel qual es barallaran ambdues molècules serà el sodi. Pot ser que en fer l'experiment que us proposem l'àcid amb què treballeu sigui un altre... això no canvia la mena de reacció que tindrà lloc a casa vostra. Nosaltres us explicarem la reacció en el cas que utilitzeu vinagre: és a dir àcid acètic. En aquest cas la reacció química que tindrà lloc és aquesta:
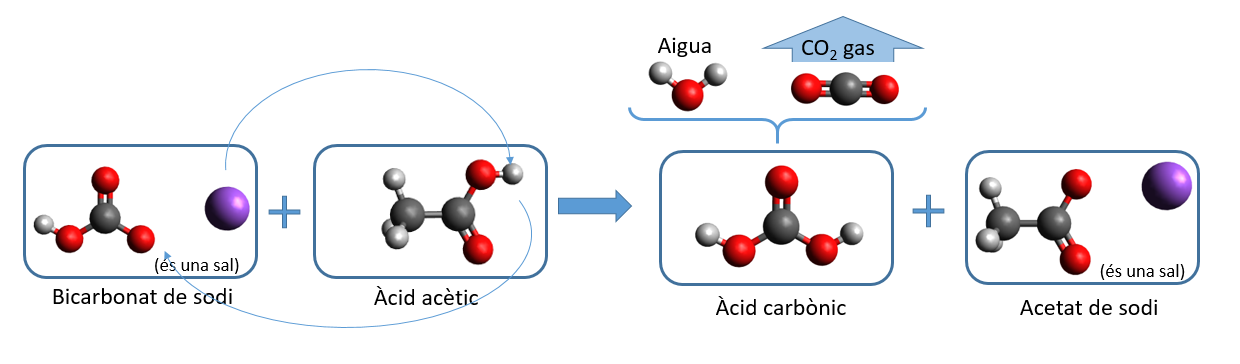
Abans de res, ja us heu adonat que el "bicarbonat de sodi" no té el sodi "dintre de la molècula", doncs és una sal*. Això es degut al fet que el sodi no està tan intensament unit a la resta d'àtoms com en el cas d'una molècula. Fixeu-vos ara en el que passa entre la sal de bicarbonat de sodi i l'àcid: l'únic que fan és bescanviar-se el sodi per l'hidrogen... sembla ser que el sodi està més a gust amb l'àcid acètic i l'hidrogen amb l'àcid carbònic**... però la història no acaba aquí...
L'àcid carbònic dissolt en 'aigua es trenca, i produeix més aigua, i diòxid de carboni (CO2). I és precisament aquesta producció de CO2 la que mesurarem, ja que el diòxid de carboni és un gas que s'escapa de l'aigua, tot formant bombolletes que en esclatar a milers produeixen el soroll característic de l'efervescència.
Com en l'experiment anterior, utilitzarem l'app "science journal", amb l'opció per mesurar intensitat sonora.
* De fet la diferència entre una molècula i una sal ve donada per com estan units els àtoms entre si: si ho fan compartint electrons formen un enllaç químic que acostuma a ser molt fort. En cas contrari, si no comparteixen electrons, i senzillament estan enganxats per forces electroestàtiques llavors tenim una sal. Per cert, is us estranya que els àtoms es puguin unir pel fet de compartir electrons no us preocupeu... té a veure amb la física quàntica, paradigma de teoria científica estranya;-)
** Evidentment els àtoms no estan a gust els uns amb els altres... la seva interacció és més o menys intensa! De fet és possible calcular com d'intensa és aquesta interacció a partir de l'entalpia de formació de cada molècula.
2.- Experimentem!
En l'experiment que us proposem barrejarem un àcid amb una sal, i mesurarem la rapidesa de la reacció química gràcies al soroll de les bombolles de CO2 que es produeixen. La reacció la farem dissolent un producte anomenat "Sal de fruites"* en aigua. En aquest cas l'àcid i el bicarbonat de sodi que conté el producte reaccionen quan entren en contacte gràcies a l'aigua. Una alternativa més bruta és barrejar directament el bicarbonat de sodi en un àcid com el vinagre (àcid acètic). L'experiment el repetirem a diferents temperatures per veure com afecta aquesta a la velocitat de reacció.
* Us donem el link a algunes marques de "Sal de fruites", com aquest (que es pot comprar a la farmàcia). També podeu comprar aquesta marca o aquesta al supermercat.
Muntatge experimental
Materials
- Telèfon mòbil i paper de film (o una funda) per protegir el mòbil (... per si de cas).
- Necessitarem també un àcid i bicarbonat de sodi. Teniu dues opcions per fer l'experiment:
- Dissoldre "Sal de fruites" amb aigua. Aquest producte el podeu comprar a la farmàcia o al supermercat. Tots tenen bicarbonat de sodi, però depenent de la marca l'àcid és "àcid cítric" o "àcid tartàric". Pel nostre experiment és igual. Aquesta opció és la millor: més neta i no fa pudor.
- Barrejar vinagre i bicarbonat de sodi. És una opció molt menys neta i pot fer malbé el telèfon mòbil.
- Dos gots iguals (de la mateixa alçada)

Procediment experimental
El procediment és el mateix per tots els experiments... l'única diferència és que els farem a diferents temperatures. Us recomanem que feu cada experiment a cada temperatura un cop sense el teléfon mòbil per assegurar-nos que no es pot fer malbé en entrar l'aigua en efervescència .
- Posem dos gots com us ensenyem al gif: un serveix per recolzar el telèfon, i l'altre és on farem la reacció.
- Omplim el got en el qual farem la reacció amb un dit d'aigua (o vinagre). Aproximadament 1/5 de la seva capacitat. Caldrà omplir el got sempre amb la mateixa quantitat de líquid!
- Recolzem el telèfon mòbil amb una funda. També podem embolicar amb film la part a sobre del got on fem la reacció química
- Encenem el sonòmetre fem silenci i posem una culleradeta de "sal de fruites" al got on tenim l'aigua: es produirà una primera efervescència molt violenta. Aquesta no ens interessa. Després es produeix una segona: és aquesta la que voldrem analitzar! Però gravarem les dues per no haver de moure el mòbil entre la primera i la segona.
- Esperem fins que l'efervescència s'estabilitzi, i llavors ja podem apagar el mòbil i guardar les dades (aproximadament un minut)
- Un primer cop a temperatura ambient (el que ja heu fet).
- Un segon cop amb aigua barrejada amb gel (O amb vinagre que heu posat a la nevera prèviament)
- Un tercer cop després de posar l'aigua 30 segons al microones
- Un quart cop amb aigua que heu posat 60 segons al microones (probablement estarà a punt de bullir)
3.- Analitzem!
Un cop acabat l'experiment podeu donar una ullada al vostre resultat. Hauríeu de veure dos pics com en aquesta figura:
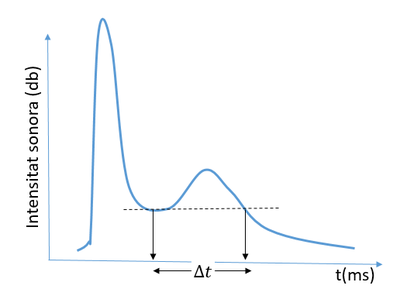
La gràfica del temps de reacció en funció de la temperatura la podeu fer amb qualsevol de les tres opcions que us donem: la clàssica, imprimint el nostre pdf i marcant els punts amb paper i bolígraf. Utilitzant algun programa com excel, origin, geogebra, matlab... Per últim podeu utilitzar també una plataforma web com codap que us permet generar gràfics d'una forma molt senzilla.
4.- Compartim!
L'experiment no està del tot controlat, ho sabem, però intentarem fer una estadística amb tots els vostres resultats a temperatura ambient, i amb l'aigua amb gel: les dues temperatures que es poden reproduir més fàcilment...Podeu accedir a l'enquesta aquí.
Nosaltres hem fet l'experiment i us expliquem els nostres resultats en aquest document.... fins i tot ens hem atrevit a calcular la velocitat de les molècules amb aquest experiment tan simple!!!!
Ens pots deixar els teus comentaris sobre aquesta iniciativa aquí.

Comparteix: